Resumen:
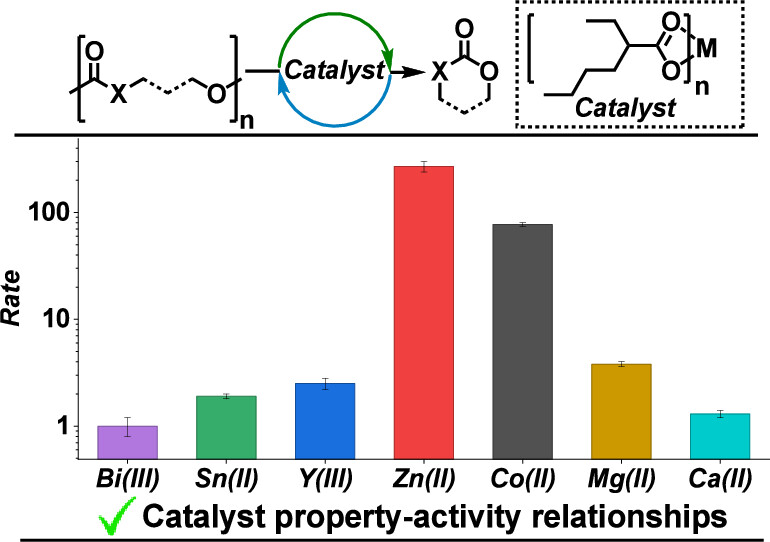
El reciclaje eficaz de polímeros es esencial para reducir la contaminación por plásticos; el reciclaje catalítico de polímeros hasta monómeros resulta especialmente atractivo, ya que permite operar a lo largo de múltiples ciclos cerrados. Los poliésteres y carbonatos alifáticos presentan propiedades que compiten con los plásticos convencionales y pueden despolimerizarse hasta monómeros cíclicos de ésteres o carbonatos de seis y siete miembros. No obstante, las reglas que gobiernan la selección de catalizadores para el reciclaje aún no están claramente definidas. En este trabajo se comparan catalizadores 2-etilhexanoato de Zn(II), Co(II), Mg(II), Sn(II), Ca(II), Ba(II), Y(III) y Bi(III) para el reciclaje químico de seis polímeros oxigenados diferentes, en masa, a bajas cargas catalíticas (1:100 a 1:1000) y temperaturas moderadas (90–170 °C). Todos los metales mostraron selectividad hacia la recuperación de monómeros, pero con diferencias claras en las velocidades de reacción, siendo el catalizador de Zn(II) consistentemente el más activo. Mediante un análisis lineal de energía libre, se encontró que la constante de velocidad de despolimerización se correlaciona directamente con la acidez de Lewis del metal, evaluada a partir de su constante de hidrólisis. Los catalizadores más eficientes corresponden a metales con acidez intermedia, como Zn(II), Co(II) y Mg(II). Esta correlación estructura–actividad se aplica a polímeros con grupos alcohólicos terminales primarios o secundarios, unidades repetitivas de seis o siete átomos y enlaces tipo éster o carbonato. El análisis de Eyring realizado con catalizadores de Zn(II), Co(II), Mg(II) y Sn(II) muestra que el Zn(II) equilibra de manera óptima las demandas entálpicas (ΔH‡ₑ) y entrópicas (ΔS‡ₑ) del estado de transición. Cálculos de teoría del funcional de la densidad de los estados de transición clave sugieren que el Zn(II) es particularmente eficaz porque activa el grupo carbonilo del polímero y, simultáneamente, facilita la labilización del nucleófilo alcoxido. Estas relaciones lineales de energía libre, de aplicación general, constituyen herramientas clave para minimizar el consumo energético y maximizar el desempeño de futuros procesos de reciclaje.
[…]
Conclusiones:
En resumen, una serie de catalizadores metálicos con acidez de Lewis mostró una selectividad muy alta y velocidades variables para el reciclaje químico mediante la despolimerización de poliésteres y policarbonatos hacia monómeros cíclicos. Todas las reacciones de reciclaje se llevaron a cabo utilizando el polímero puro, con bajas cargas catalíticas (1:100–1:1000) y a temperaturas moderadas (90–170 °C). El catalizador de Zn(II) presentó las velocidades más rápidas, siendo más de 1000 veces más veloz que los catalizadores menos activos de la serie. Después del Zn(II), los catalizadores más eficientes fueron los basados en Co(II) y Mg(II). Se identificó una correlación útil entre la estructura del catalizador y su desempeño, específicamente entre la acidez de Lewis del metal, evaluada mediante su constante de hidrólisis, y la velocidad de despolimerización. Esta relación lineal de energía libre es aplicable a una amplia gama de polímeros y a todos los catalizadores estudiados. El análisis de Eyring, realizado con los catalizadores principales Zn(II), Co(II), Mg(II) y Sn(II), sugiere que el Zn(II) es el metal más eficaz para equilibrar las barreras entrópicas y entálpicas del estado de transición durante la despolimerización. En conjunto, la relación estructura–desempeño del catalizador, o relación lineal de energía libre, proporciona un marco conceptual valioso para futuras investigaciones tanto en el diseño de catalizadores como de procesos de reciclaje, y permite la selección racional del polímero y del catalizador para lograr un reciclaje más rápido y con menor consumo energético.
Consulte el artículo completo en este enlace
Información tomada y traducida del artículo científico publicado en Journal of the American Chemical Society.
Imagen tomada del artículo.